*仅供医学专业人士阅读参考
乳腺癌是严重威胁全世界女性健康的恶性肿瘤,其中激素受体阳性/人表皮生长因子受体2阴性(HR+/HER2-)是乳腺癌最常见的亚型,约占新发乳腺癌的70%[1]。中国每年新发乳腺癌病例中,约3%~10%的妇女在确诊时即有远处转移。早期患者中,30%可发展为晚期乳腺癌,晚期乳腺癌患者5年生存率仅为20%[2]。晚期乳腺癌是乳腺癌发展的特殊阶段,在治疗选择和疗效方面均不同于乳腺癌的其他阶段。这些患者不仅要承受疾病本身的负担,还要面对心理上和经济上的巨大压力。
HR+晚期乳腺癌患者以内分泌治疗为基石
内分泌治疗是激素受体阳性(hormonereceptor-positive,HR阳性)乳腺癌患者主要的全身治疗手段。乳腺癌的内分泌治疗经历了百年发展历史,他莫昔芬(tamoxifen,TAM)、三种常见芳香化酶抑制剂(aromataseinhibitors,AI)、氟维司群(fulvestrant)是乳腺癌内分泌治疗的基本药物。对于HR+晚期乳腺癌的治疗,国内外指南[3-4]均指出:内分泌治疗是HR+晚期乳腺癌的治疗基石。即使存在内脏转移,以内分泌为基础或联合治疗依然是优选治疗方案,但要结合HR表达状态、内分泌治疗的敏感性、疾病发展速度、肿瘤负荷、身体条件等综合决定。

图1:中国抗癌协会乳腺癌诊治指南与规范(2024简要版)

图2:2024V4NCCN乳腺癌指南更新
在单药内分泌治疗时代,AI和氟维司群均是HR阳性HER2阴性MBC的标准方案,对于疾病发展缓慢、非内脏危象患者首选内分泌治疗,临床实践中多数内脏转移甚至内脏危象患者接受化疗作为起始治疗。随着CDK4/6抑制剂的陆续上市、内分泌治疗药的医保政策变化,以CDK4/6抑制剂为基础联合内分泌治疗的方案成为一线主流。由于HR阳性患者在早期往往会接受多种内分泌治疗,因此对于晚期患者,国内指南更新遵照患者既往治疗的不同而予以分层治疗策略。对于肿瘤负荷大、内脏危象的患者,Rightchoice研究[5]为内分泌联合CDK4/6抑制剂治疗提供了证据。该研究是针对高侵袭性HR阳性HER2阴性MBC(内脏危象占比52.3%)一线治疗的随机对照Ⅱ期研究,ER表达≥50%阳性的患者占比85.6%,结果显示:与联合化疗相比,内分泌联合CDK4/6抑制剂显著延长患者的PFS(24.0比12.3个月,HR=0.54,P=0.0007)。
遵循2024版CSCO指南[6]的分层治疗策略,对于既往未经内分泌治疗或者TAM治疗失败的患者,可以优选AI联合CDK4/6抑制剂。对于HR阳性乳腺癌患者,在早期治疗阶段,AI是主要的治疗手段。然而,随着治疗时间的延长,患者对AI产生耐药性的风险逐渐增加,特别是在晚期患者中,AI耐药的情况更为普遍。对于SAI或NSAI治疗失败的患者,推荐将氟维司群与CDK4/6抑制剂的联合疗法作为I级推荐。多项研究如MONARCH2/plus[7]证实了氟维司群与阿贝西利CDK4/6抑制剂联合使用在治疗晚期HR阳性乳腺癌中的显著疗效。在乳腺癌细胞中,CDK4/6抑制剂能通过抑制细胞周期素D1与CDK4/6激酶的结合,阻断Rb蛋白磷酸化,从而阻滞细胞周期从G1期到S期的进程,抑制肿瘤细胞增殖,对ER阳性乳腺癌具有延缓和逆转内分泌耐药的作用[8]。
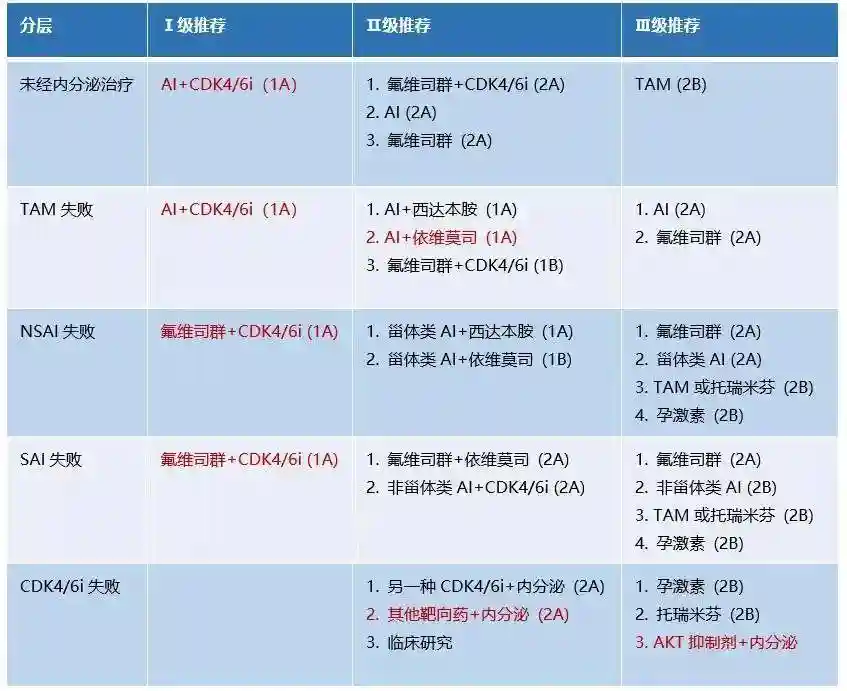
图3:2024CSCOBC指南
新型内分泌及靶向药物的探索
对于CDK4/6抑制剂治疗失败的患者,寻找新的治疗策略已成为临床工作中的紧迫任务。随着CDK4/6抑制剂在一线、二线乃至辅助强化治疗中的广泛应用,越来越多的患者面临着在长期用药后疾病再次进展的挑战。这些患者急需新的治疗方法,以期能够维持较高的生活质量并实现长期带瘤生存。
[9]等系列研究中取得了积极的结果,特别是对于携带ESR1突变的患者[10]。晚期阶段在CDK4/6i抑制剂失败后,口服SERD优势人群的筛选,前线与CDK4/6i联合使用有效性的探索,辅助阶段在高风险人群中联合或不联合CDK4/6i,进一步降低患者死亡率,是当下口服SERD临床试验的热点。
当前,HR+晚期乳腺癌患者内分泌治疗的另一个趋势是与靶向治疗进行联合,其效果优于单药内分泌治疗。若一线治疗中患者未接受CDK4/6抑制剂治疗,二线治疗患者仍然可以选择CDK4/6抑制剂联合内分泌进行治疗。除CDK4/6抑制剂外,其他靶向药物也可以和内分泌治疗联合应用。如AKT抑制剂、PI3K抑制剂、HDAC抑制剂、mTOR抑制剂、ADC药物等,正在逐渐改变HR+晚期乳腺癌治疗格局,给患者带来更多选择和更长的生存。
约50%HR+/HER2-乳腺癌患者存在PI3K/AKT/PTEN通路基因的突变,以PIK3CA基因为主[11];既往研究数据报道中国人群PIK3CA突变率约32%-50%[12],全球突变率31-40%[11]。与白种人相比,中国乳腺癌人群的AKT1基因突变频率更高,约4-8%[12]。PAM信号通路在乳腺癌中的异常激活不仅是疾病进展的关键驱动因素,也与治疗耐药性的形成和加剧密切相关,这种过度激活对内分泌治疗、化疗以及靶向治疗的耐药性产生了深远的影响。雌激素受体与雌二醇结合后,能激活PAM通路信号,促进肿瘤细胞生长。PAM通路也可磷酸化ER,使其在不依赖雌激素的情况下被激活,并基于细胞核发挥转录作用,促进肿瘤细胞增殖。此外,PAM信号通路的激活还能调节与该通路相关的蛋白活性,间接参与CDK4/6抑制剂和抗HER2治疗的耐药性形成过程,这进一步增加了乳腺癌治疗的复杂性[13]。既往多项研究显示,与PAM通路正常的乳腺癌患者相比,存在通路基因改变者肿瘤进展风险更高,DFS及OS更差。一项纳入7项研究的Meta分析显示,PIK3CA基因特定激活突变是乳腺癌的独立不良预后因素(HR=1.67,p=0.007),显著增加了疾病进展与死亡风险(HR=2.05,p=0.002)[14]
此外,组蛋白去乙酰化酶(HDAC)抑制剂通过抑制相关HDAC亚型以增加染色质组蛋白的乙酰化水平来引发染色质重塑,并由此产生针对肿瘤发生的多条信号传递通路基因表达的改变(即表观遗传改变),能够诱导肿瘤干细胞分化、逆转肿瘤细胞的上皮间充质表型转化(EMT)等作用,进而在恢复耐药肿瘤细胞对药物的敏感性和抑制肿瘤转移、复发等方面发挥潜在作用[14]。HDAC抑制剂在中国已有多年的临床应用经验,在后线治疗中为改善耐药性提供了新的方案。比如,西达本胺联合依西美坦在绝经后HR+/HER2-ABC患者中显示出良好的疗效和安全性,然而HDAC抑制剂尚未纳入医保,这在一定程度上限制了它们在临床实践中的广泛应用。
免疫治疗在TNBC中势如破竹,很多中心开始在HR+HER2-乳腺癌围术期中探索免疫治疗的价值。在I-SPY2[15]的一个HR+/HER2-队列中,证实了新辅助帕博利珠单抗联合化疗能有效地提高pCR率。而在另一个队列中,免疫联合治疗不仅提高了HR+/HER2-患者的pCR率,更进一步通过MammaPrint基因检测识别出对联合治疗获益更多的超高危人群。在3期临床研究CheckMate7FL[16]和KEYNOTE-756[17]研究中,均观察到了新辅助化疗联合ICI治疗对pCR的提高。我们也期待这两项研究未来生存数据的公布,将给与我们更多的信心,针对高危人群、优势人群进行更多免疫治疗的尝试。
总体而言,HR阳性晚期乳腺癌的治疗领域迎来了变革,随着CDK4/6抑制剂被纳入最新的治疗指南作为推荐的治疗方案,医生在治疗晚期HR阳性乳腺癌时需要决定使用哪种具体的药物。医生可以考虑中国批准的适应症差异、药物的可及性、不良反应的管理、患者的治疗史以及患者对药物的耐受性和依从性等因素,来定制化地选择药物。这种更新赋予了医生更大的选择灵活性,以便更精准地满足患者的个性化治疗需求。而在后CDK4/6抑制剂时代,随着基因检测技术的进步和新药的不断涌现,乳腺癌的精准诊疗正逐渐成为现实,包括ESR1、PAM等基因突变检测在内的内分泌靶向治疗方案,将为国内患者带来更多获益。
注:指南内容涉及阿斯利康未获批产品/适应症,阿斯利康不推荐任何未获批药品/适应症的使用。
专家简介

方延曼教授
贵州妇幼乳腺专科联盟负责人;贵阳市科普专家
中国妇幼保健协会青年委员会委员;中国妇幼保健协会乳腺保健专业委员会委员
中国光华科技基金会长江学术带乳腺联盟(YBCSG)常务委员
中国研究型医院学会乳腺专业委员会委员;北京癌症防治学会乳腺癌青年委员会委员
贵州省抗癌协会乳腺癌专业委员会青年委员会第一届专业委员会副主任委员
贵州省乳腺疾病专科联盟第一届常务理事
贵州省抗癌协会第一届乳腺癌专业委员会委员
长按识别二维码
精彩资讯等你来
参考文献:
[1]Howlader,N.,etal.(2014).USincidenceo,106(5),dju055.
[2]Gonzalez-Angulo,,Morales-Vasquez,F.,Hortobagyi,(2007).(,).
[3]中国抗癌协会乳腺癌诊治指南与规范(2024简要版).(2024).中国抗癌协会.
[4]2024V4NCCN乳腺癌指南.(2024).NationalComprehensiveCancerNetwork.
[5]Millis,,etal.(2016).RibociclibplusgoserelinwithhormonaltherapyversusphysicianchoicechemotherapyinpremenopausalorperimenopausalpatientswithHR+,HER2–inoperablelocallyadvancedormetastaticbreastcancer:,2(12),1565-1573.
[6]2024CSCO指南.(2024).中国临床肿瘤学会.
[7]MONARCHplus:abemaciclibplusocrinetherapyinwomenwithHR+/HER2-advancedbreastcancer:themultinationalrandomizedphaseIIIstudy.(2020).TherAdvMedOncol.
[8]李睿,王斌,贾红燕.(2021).乳腺癌治疗中周期蛋白依赖性激酶4/6抑制剂耐药机制研究进展.中华实验外科杂志,38(4),784-789.
[9]Elacestrant(oralselectiveestrogenreceptordegrader)VersusStandardocrineTherapyforEstrogenReceptor-Positive,HumanEpidermalGrowthFactorReceptor2-NegativeAdvancedBreastCancer:;40(28):3246-3256.doi:10.1200/
[10]EkaterineAr,,anextgenerationoralSERDvsfulvestrantinpost-menopausalwomenwithadvancedER-positiveHER2-negativebreastcancer:Resultsoftherandomized,multi-dosePhase2SERENA-2trial[abstract].SanAntonio,(PA):AACR;CancerRes2023;83(5Suppl):AbstractnrGS3-02.
[11]Oliveira,M.,Pominchuk,D.,Nowecki,Z.,etal.(2023).Camizestrant,anextgenerationoralSERDvsfulvestrantinpost-menopausalwomenwithadvancedER-positiveHER2-negativebreastcancer:resultsoftherandomized,,83(5_Supplement),GS3-02.
[12]Sobhani,N.,Roviello,G.,Corona,,etal.(2018).TheprognosticvalueofPI3Kmutationalstatusinbreastcancer:,119(6),4287–4292.
[13]Glozak,,Seto,E.(2007).,26(37),5420-5432.
[14]Jiang,,etal.(2024).PI3K/AKT/mTOR信号通路抑制剂治疗乳腺癌临床应用专家共识.中华肿瘤杂志,44(07).
[15]CampbellM,YauC,BorowskyA,(assessedviamultiplexfluorescenceimmunohistochemistry)andimmunegeneexpressionsignaturesaspredictorsofresponsetothecheckpointinhibitorpembrolizumabintheneoadjuvantI-SPY2trial(AbstractPD6-08).;78(4)(suppl).doi:10.1158/1538-7445.SABCS17-PD6-08.
[16]LoiS,McArthurHL,HarbeckN,ocrinetherapyinER+/HER2–primarybreastcancer:;38(suppl15):TPS604.
doi:10.1200/_
[17]FatimaCardoso,JoyceO’Shaughnessy,,FollowedbyAdjuvantPembrolizumabor
PlaceboPlusocrineTherapyforEarly-StageHigh-RiskER+/HER2−BreastCancer:
审批编号:CN-145183有效期至:2025-10-10
材料由阿斯利康支持,仅供医疗卫生专业人士参考
*此文仅用于向医学人士提供科学信息,不代表本平台观点





.jpeg)











