文丨邻村胡大爷
前言干细胞引起了人们对研究的极大兴趣;自从被发现以来,它们自我更新和分化成成熟成体细胞的能力使它们非常有希望用于人类组织的再生,使用它们的第一批成果促成了“再生医学”的真正定义,这绝非偶然。

干细胞及其分化的衍生物越来越多地用于不断扩大的细胞研究领域,目的通常是治疗与各种疾病相关的细胞损失状况。
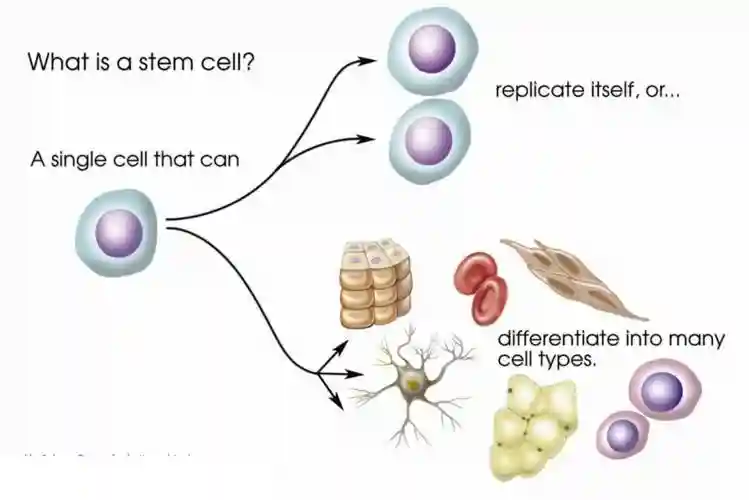
干细胞分裂可以产生具有额外祖细胞和子干细胞的不对称后代。它们表现出自我更新和再生的能力。干细胞的分化能力取决于其分化潜能。
成体干细胞的更新是有限的,因为它们只能分化成单个组织的特定细胞。找到能够分化成所有组织类型的干细胞是一个挑战。如果可以到达所有的终末细胞群,则称这些细胞具有全能性,而追求更有限的表型模式的能力是多能性的性质。
神经干细胞产生神经元、少突胶质细胞和星形胶质细胞。寡能干细胞产生一些密切相关的细胞类型。单能干细胞产生单一细胞类型科学家传统上处理两种类型的动物和人类干细胞:胚胎干细胞和非胚胎“体细胞”或“成体”干细胞。
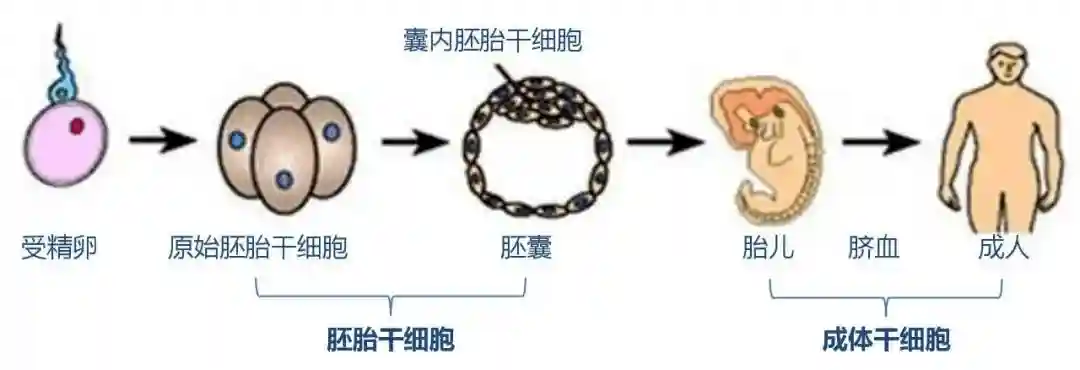
大约30年前,在1981年,研究人员发现了如何从早期小鼠胚胎中获得胚胎干细胞。1998年,通过对小鼠干细胞生物学的深入研究,发现了一种从人类胚胎中提取干细胞并在实验室中培养这些细胞的方法。
人类胚胎干细胞是这些细胞的名称。这在试管内这些研究中使用的受精技术被用来生产用于生殖的胚胎。当该功能不再需要他们时,在捐赠者知情同意的情况下,他们被给予研究。胚胎干细胞拥有强大的特性,但是它们的使用违背了伦理原则。
为此它受到了限制。今天已经有并且将来可能还会继续有一场关于它们的使用,关于它们在培养中保持14天以上的可能性,以及与它们相关的所有社会、道德和伦理问题的辩论。
干细胞具有自我更新的能力,即产生自身的副本,并分化成谱系群体,即发育成更特化的细胞,这允许在多细胞生物中存在的相应组织中进行细胞更新。组织特异性干细胞的产生是复杂生物体生命周期中的一个必要步骤,通常有助于所有组织类型的细胞更新,以促进生物体的发育。
3-5天胚胎的核心细胞,称为胚泡,产生完整的生物体,包括许多特化的细胞类型和器官,如心脏、肺、皮肤、精子、卵子和其他组织。
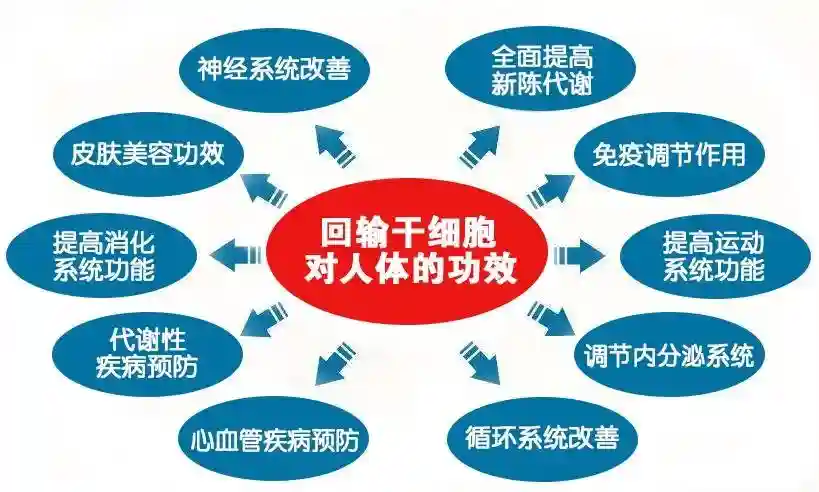
不同的ASC群体为不同成人组织中由于自然磨损、损伤或疾病而丢失的细胞提供替代物。由于干细胞非凡的再生能力,干细胞为解决这些疾病提供了新的治疗可能性。
科学家可以通过实验室研究来研究干细胞的基本特征以及它们与其他专门细胞类型的区别。在实验室中,研究人员已经在使用干细胞来测试新药,系统来研究健康生长,并查明出生异常的原因。通过干细胞研究,对生物体如何从单细胞生长以及健康细胞如何取代成年生物中受损细胞的理解已经有所进展。
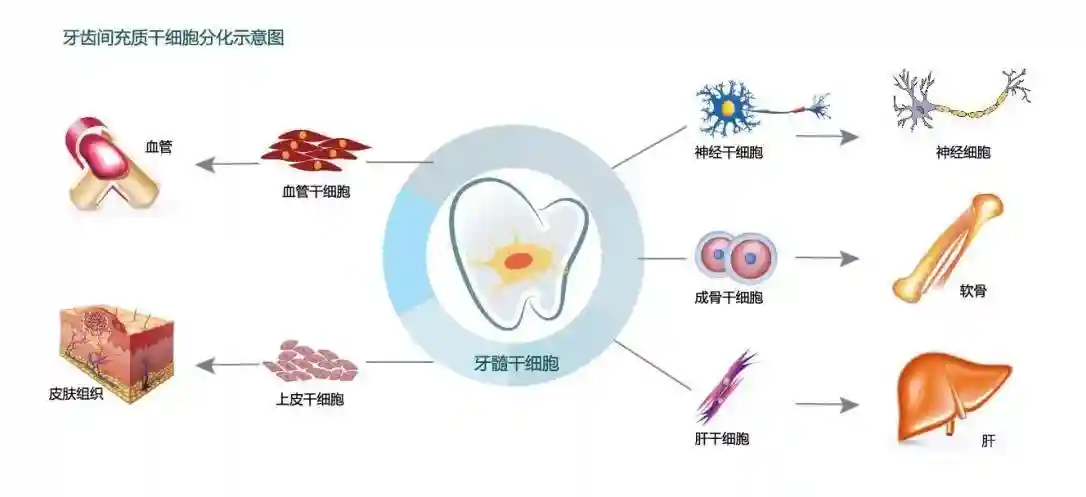
ASCs是在身体的一些分化组织中发现的未分化细胞,具有自我更新或产生新细胞来替代受损或死亡组织的可能特性。ASCs有时被称为“体细胞干细胞”,其中术语“体细胞”是指身体的非生殖细胞。干细胞的一些例子是:上皮和皮肤干细胞、神经干细胞、造血干细胞、间充质干细胞。
ASC在天然组织中通常不足,这使得它们难以研究和收获用于研究。存在于人体大多数组织中的不同ASCs群体产生新的细胞来替代由于自然修复、疾病或损伤而丢失的细胞。
人的所有组织,包括脐带、胎盘、骨髓、肌肉、大脑、脂肪组织和脂肪抽吸物、皮肤、胃等。包括ASC。
1948年,第一批干细胞被取出并用于制造血液。当1968年第一批成人骨髓细胞用于血液疾病的临床治疗时,这一过程得到了扩展。40多年来,血液疾病如白血病和淋巴瘤的治疗包括外周血干细胞和骨髓移植。
有一个正在进行的辩论。根据一些研究,ASCs只能产生其所在组织的细胞类型。然而,其他研究表明,干细胞可能能够产生其他组织类型的细胞。需要更多的研究来澄清这一方面。
科学家已经证明ASC存在于大多数身体组织中。科学研究正在寻找定位、分离和繁殖这些细胞用于治疗的方法。
ASC的大部分生物学效应可能是由影响周围细胞的细胞外泡介导的,如外来体。外来体疗法的当前发展需要有效和非侵入性的方法来定位、监测和追踪外来体。这些疗法背后的想法是,外泌体和释放的化学物质是干细胞显示其治疗功能的方式。
外来体是包括肽、mRNA和微小核糖核酸的囊泡,大小范围从50到150纳米,是细胞间通讯所必需的。它们通过向受体细胞输送生理活性化学物质来模拟干细胞移植的效果,从而改变它们的基因表达和行为。

胚胎在这个阶段被称为胚泡,在受精后3到5天,植入前,包含能够生长构成人体的所有特化组织的内细胞团。胚胎干细胞是由胚胎干细胞的内细胞团产生的在试管内受精胚胎,捐赠用于科学研究。胚胎干细胞不是由在女性体内受精的卵子制成的。
这些多能干细胞只能在发育的早期阶段分离,实际上可以发育成任何细胞形式,研究目标之一是了解这些细胞在发育过程中如何分化。关于这些发育阶段的知识的逐渐增加,可以允许研究人员使用ESCs生成在试管内为移植重建不同类型的组织,如神经元、皮肤、肠道和肝脏。
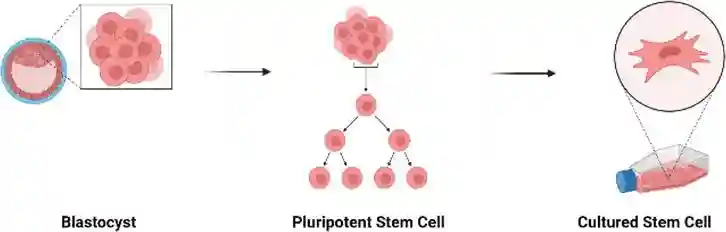
在未来,ESCs可以用于治疗更广泛的疾病。人们希望,一旦这项技术得到很好的理解,这些信息将应用于车辆ESC,即诱导它们分化为患者治疗所需的特定细胞类型,目前,用ESCs移植治疗的疾病包括糖尿病、脊髓损伤、肌营养不良、心脏病和视力/听力损失。

介于ASCs和ESCs之间的是iPSCs,iPSCs是在实验室中通过将胚胎基因引入体细胞如皮肤细胞中,使其回到“干细胞样”状态而产生的干细胞。这些细胞的产生是基因重编程的一种创新技术。2006年首次发现,在用于治疗前还需要几年的研究。
将受体体细胞改变为“类ESC”状态的潜力无疑使得使用iPSCs的治疗具有吸引力。使用这些iPSC细胞的适当分化过程可以产生治疗所需的细胞。这项技术之所以吸引人,是因为它避免了终身组织相容性免疫抑制的需要,就像供体干细胞的移植细胞一样。
iPSC细胞被认为是多能性的,这使它们与大多数ESCs相似。与ESCs不同,iPSCs的操作在胚胎细胞外层的生长中并不成功,这是细胞发育成完整的人类个体所必需的。但是,iPSC研究正迅速转向转化和临床应用。
干细胞培养的前景面对使用不同干细胞的可能性,应该记住,这些细胞可以大量使用供体体细胞,从而使自体治疗成为可能。来自供体而非受体的典型组织相容性问题,通常是排斥的主要原因,是可以避免的。干细胞可用于一些感兴趣的领域,如药物开发或开发研究。

一般来说,组织特异性干细胞被认为不如胚胎干细胞适应性强。在干细胞被识别和分离后,必须创造正确的环境,在这种环境中,细胞可以分化成特定治疗所需的特化细胞。
必须建立一个将细胞运输/迁移到它们要发挥作用的身体区域的系统。只有在这个区域,细胞才必须发挥作用,与身体的天然细胞结合。然而,尽管细胞可以化学识别受伤的组织,但可能存在物理障碍,如阻塞的动脉,阻止这些细胞“旅行”到受损区域。如果堵塞的根本原因没有消除,组织再生的速度将会很差、很慢或不存在。
像器官移植一样,可能有必要抑制身体的免疫系统,以减轻由捐赠细胞引发的免疫反应。应该考虑到,身体可能对祖细胞的添加产生负面反应,导致肿瘤的形成或加速其生长速度。毫无疑问,肿瘤学领域是一个必须加强细胞治疗研究的领域,因为它有潜力,但需要采取适当的措施。
自2001年以来,已经开发了数百种干细胞系;这些线路比近十年前建立的线路适应性更强,也更容易处理。它们还具有不被其他细胞产生的“污染”的优势。
鉴于新细胞系的优势,美国国立卫生研究院或其他竞争性资助组织不太可能支持仅限于旧细胞系的实验,尽管动物模型取得了令人鼓舞的结果,但对干细胞及其在治疗各种人类疾病方面的潜在用途的研究仍处于起步阶段。为了保证长期疗效和安全性,应遵循彻底的研究过程。

干细胞研究有助于了解生物体如何生长和发育,以及组织如何在整个成年生活中得以维持。了解疾病和损害过程中的问题以及最终如何治疗这些疾病是必要的。在开发人体组织和干细胞系以及相关生物产品的帮助下,研究人员将有办法模拟疾病,测试药物,并创造越来越有效的治疗方法。
有两个因素使得疾病或患者特异性多能干细胞的产生在治疗上极具前景。这些细胞可能为研究人类疾病的原因和开发新药提供一个强有力的新工具。生成的ESCs可以转化为特定的细胞类型,如果移植到原始供体中,将被认为是“自体的”,从而消除了从无关供体移植时出现的免疫抑制和排斥问题。这项研究必须继续下去,释放干细胞的潜力,进一步推进再生医学。
参考文献














